Klíčová slova: mnohočetný myelom, osteolytické změny, autologní
transplantace krvetvorných buněk (ASCT)
Souhrn:
Mnohočetný myelom je onemocnění, které postihuje zejména starší
osoby. Díky neustálému vývoji nových terapeutických modalit máme pro
nemocné k dispozici více linií léčby, což má pozitivní vliv na růst průměrného
přežití od stanovení diagnózy. Mnohočetný myelom je druhou nejčastější
hematologickou malignitou v západních průmyslových zemích. V Evropě se
vyskytuje přibližně 6 nových případů na 100 000 obyvatel. Průměrný věk
pacientů v době diagnózy je přibližně 70 let. Medián doby přežití se za
posledních dvacet let zdvojnásobil. Pacienti přežívají s počáteční moderní
kombinovanou léčbou v průměru 8–10 let; pacienti, kteří nedostávají intenzivní
léčbu, žijí v průměru 5 let. Příznaky mnohočetného myelomu, jako jsou
slabost, únava, úbytek hmotnosti a bolesti zad, jsou nespecifické, proto bývá
prodleva do stanovení diagnózy relativně dlouhá. Medián doby do jejího
stanovení jsou 3 měsíce od objevení se prvních příznaků. Z retrospektivního
pohledu pacientů je doba od nástupu příznaků do stanovení diagnózy
uváděna dokonce 6 měsíců. Až 80 % pacientů udává bolest kostí. Dalšími
častými příznaky onemocnění jsou anemie (minimálně 50 % pacientů),
zhoršení funkce ledvin nebo proteinurie (50 %) a hyperkalcemie (až 15 %).
Cílem sdělení je podat stručný přehled o mnohočetném myelomu lékařům,
kteří se nezabývají hematologií, ale s dosud nediagnostikovanými pacienty
se mohou setkat a již jen zvážením možnosti onemocnění mnohočetným myelomem
mohou zásadně přispět ke stanovení správné diagnózy a zlepšení
jejich prognózy. Autoři také chtějí poukázat na časté chyby a omyly v diagnostickém
procesu. Sdělení je doplněno autentickými kazuistikami z denní
praxe autorů.
Mnohočetný myelom (historicky Kahlerova nemoc nebo plasmocytom; MM) je systémové onemocnění ze skupiny B-buněčných lymfomů, při němž dochází k difuzní nebo mnohočetné infiltraci kostní dřeně maligním klonem transformovaných plasmocytů
(myelomových buněk). Charakteristická je výrazná intraklonální heterogenita, v průběhu onemocnění může perzistovat stejný klon jako při stanovení diagnózy, ale současně může docházet ke vzniku nových mutací.
Incidence MM je 6/100 000, střední věk v době stanovení diagnózy 70 let s mírnou převahou mužů. Jde o nejčastější malignitu skeletu a kostní dřeně s dosud neznámou etiologií, za rizikový faktor je považováno ionizované záření, dále pak zřejmě riziko
vzniku onemocnění zvyšují pesticidy a chronické infekce.
Přes zmíněnou intraklonální variabilitu produkují všechny klony myelomových buněk imunoglobuliny jednotné struktury (tzv. idiotyp) – monoklonální imunoglobuliny (IgG v 53 %, IgA v 25 %, raritně IgD asi v 1 % případů) = paraprotein, nebo jen volné lehké řetězce (kappa [κ] a lambda [λ] – celkově 20 % případů, tzv. Bence-Jonesův myelom). V 1 % případů jde o tzv. asekretorický (nesekreční) myelom. Myelomové buňky nevykazují
vlastní osteolytickou aktivitu, ale vedou ke stimulaci osteoklastů a k supresi funkce osteoblastů.
Ve 20 % případů je myelom zachycen náhodně v asymptomatickém stadiu. Obecné symptomy jsou spíše nespecifické (únava, schvácenost, anorexie, váhový úbytek, bolesti zad), k rozvoji symptomů obvykle dochází až ve stadiu komplikací (kostní symptomatologie, hyperkalcemie, myelomová ledvina, změny v krevním obraze, náchylnost k infekcím, hyperviskózní syndrom, případně AL amyloidóza).
Komplikace mnohočetného myelomu:
- Osteolytická ložiska ve skeletu (u 80 % nemocných) se manifestují bolestí a vznikem spontánních fraktur při neadekvátním traumatu.
Vždy je nutné odlišit postižení skeletu myelomem od metastatického rozsevu solidních tumorů (viz dále) - Hyperkalcemická krize se rozvine asi u 15 % nemocných. Často je způsobena osteolytickým procesem, symptomy jsou poměrně nespecifické
(polyurie, zvracení, somnolence). Poměrně častým důsledkem je zhoršení renální funkce, případně akutní poškození ledvin - Myelomová ledvina (postihující asi 30 % nemocných s MM) je souhrnné označení pro postižení ledvin depozity paraproteinu nebo lehkých
řetězců v renálních tubulech (tzv. cast nephropathy – odlitková nefropatie), v bazální membráně glomerulů nebo formou AL amyloidu. Typickým
nálezem je proteinurie (až nefrotický syndrom) a rozvoj renální insuficience až u 50 % nemocných, přibližně 10 % nemocných dospěje do stadia
nutnosti dialýzy. Zde je nutné upozornit na nutnost pravidelné monitorace močového nálezu a na nutnost prevence renálního poškození (adekvátní
hydratace, eliminace nefrotoxinů, například nesteroidních antiflogistik) - Anemie různého stupně se vyvine přibližně u 50–75 % nemocných s myelomem. Mikrocytární anemie, jakou vídáme u chronických krevních ztrát,
není typickým obrazem anemie při myelomu. Častější je normocytární, případně makrocytární anemie způsobená přímým vlivem maligních buněk
na krvetvorbu a supresí zdravé kostní dřeně - Protilátkový deficit se zvýšenou náchylností k infekcím (častější při současné leukopenii) postihuje až 90 % nemocných
- Polyneuropatie je způsobena depozicí volných lehkých řetězců
- Hyperviskózní syndrom (se zvýšením celkové bílkoviny typicky nad 100 g/l) je podmíněn zvýšením krevní viskozity v důsledku vzniku polymerů
(hlavně IgM/IgA). Typickým projevem hyperviskózního syndromu jsou poruchy mozkové cirkulace (zmatenost, závratě). Pokud dochází k polymerizaci
imunoglobulinů při nižších teplotách, hovoříme o kryoglobulinemii – poruchy akrálního prokrvení charakteru Raynaudova syndromu - V některých případech dochází k vazbě monoklonálních imunoglobulinů na koagulační faktory, což může mít za následek (především v případě
současné trombocytopenie) krvácivé projevy - Závažnou komplikací mnohočetného myelomu je AL amyloidóza (do 10 %), která může vést k postižení srdce, ledvin, zažívacího traktu, jater
a nervového systému s často fatálními komplikacemi (srdeční a renální selhání, těžké hypotenze při orgánovém selhání a neuropatii, náhlá srdeční
smrt při autonomní neuropatii atd.). Současně dochází ke značnému snížení kvality života. - Další komplikace představují různé sekundární malignity (např. akutní myeloidní leukemie)
Diagnóza MM je potvrzena při splnění následujících kritérií:
- Více než 10 % plazmatických buněk v kostní dřeni nebo průkaz extramedulárních
ložisek plazmatických buněk (histologický nález) a současná přítomnost některého z vyjmenovaných projevů (orgánové poškození nebo pozitivita biomarkerů) - Orgánové komplikace způsobené plazmatickými buňkami (kritéria CRAB –
hyper(c)alcemie, renální postižení, anemie, kostní (bone) symptomatologie). Musí být dána souvislost mezi vlivem plazmatických buněk a rozvojem těchto komplikací:
- hyperkalcemie nad 2,75 mmol/l (při
abnormálně nízké hladině albuminu je nutné
sérové kalcium korigovat na albumin);
zjednodušená diferenciální diagnostika
hyperkalcemie je uvedena v tabulce níže. - renální postižení (kreatinin nad 177
μmol/l nebo jeho clearance pod 40 ml/
min) - anemie (Hb pod 100 g/l nebo snížení
o 20 g/l pod normu) - jedna nebo více kostních lézí (dnesprokázaných nejčastěji nízkodávkovým CT
skeletu, PET-CT nebo magnetickou rezonancí).Prostý rentgenový snímek bolestivého místa může vést ke správné diagnóze, aleskiagramy lebky a dlouhých kostí se dnes provádějí podstatně méně než v minulosti. Scintigrafie skeletu není vhodná pro detekci MM, může však pomoci zachytit jiné maligní onemocnění skeletu
- Pomocí nověji užívaných biomarkerů, zahrnutých do nových diagnostických
a stagingových kritérií (plazmatické buňky, volné lehké řetězce, magnetická rezonance), lze identifikovat pacienty s vysokým rizikem progrese nemoci
Diferenciální diagnostika hyperkalcemie a zjednodušený diagnostický algoritmus

Laboratorní vyšetření:
- Extrémně zvýšená sedimentace (nad 100 mm/h) – zde je nutné upozornit, že
vyšetření sedimentace červených krvinek především v rámci screeningu má stále svůj význam i přes rozšíření novějších zánětlivých markerů jako CRP a prokalcitonin. Vysokou sedimentaci je nutné vždy objasnit. - Proteinurie s přítomností volných lehkých řetězců (free light chains, FLC) v moči
(Bence-Jonesova proteinurie, nelze zachytit běžnými diagnostickými proužky založenými na detekci albuminu, průkaz pomocí imunofixace moči). Historicky byla užívána zkouška s kyselinou sulfosalicylovou. Bence- Jonesova bílkovina v moči je přítomna vždy při MM z FLC a v 60 % případů IgG a IgA MM - Zavedení rutinní diagnostiky FLC (Freelite) v séru představovalo podobný pokrok jako zavedení glukometrů a opuštění diagnostiky diabetu pomocí detekce
glykosurie. Jde o citlivé a specifické testy ke stanovení FLC κ a λ, které jsou založeny na afinitně purifikovaných polyklonálních protilátkách navázaných na latexové částice. Jde o podstatně senzitivnější metodu než imunofixace a využití má k hodnocení remise, jako prognostický faktor při MGUS
a u doutnajícího MM - Celková bílkovina je typicky zvýšena, velmi častá je diskrepance mezi zvýšenou celkovou bílkovinou (nebo horní hranicí normy u celkové bílkoviny) při snížení
albuminu - Imunofixace k průkazu monoklonálního proteinu
- Elektroforéza (elfo) bílkovin: tzv. M-gradient (monoklonální gradient) většinou v oblasti gamaglobulinů (paraprotein). Může uniknout pozornosti u IgA myelomu,
chybí u Bence-Jonesova MM a nesekrečního MM. Kvantifikace paraproteinu
a fyziologických (normálních) imunoglobulinů se provádí pomocí imunonefelometrie nebo turbidimetrie. Paraproteiny nemají obrannou funkci, proto dochází k deficitu protilátek i přes vysokou gamma frakci - β2-mikroglobulin koreluje s myelomovou masou, tíží renální insuficience a má
prognostický význam. Je základem i v současnosti užívaného stagingového schématu (International Staging System, ISS, 2005, a Revised ISS, 2015), které nahradilo starší klasifikaci dle Durieho a Salmona. Aktuální stagingové schéma zahrnuje dále albumin, LDH a zohledňuje také cytogenetický nález
Diferenciální diagnostika mnohočetného myelomu. Nejčastějšími projevy vedoucími k diagnóze mnohočetného myelomu jsou kostní léze, anemie, renální insuficience, hyperkalcemie (CRAB kritéria)
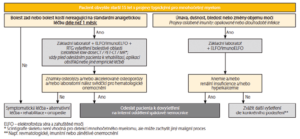
Diferenciální diagnóza
- Sekundární monoklonální gamapatie při jiných onemocněních krvetvorby (např.
CLL, NHL), dále u autoimunitních onemocnění atd. - Monoklonální gamapatie neurčeného významu (MGUS)– raritní v mladším
věku, až 5 % starších pacientů nad 70 let:
- nízká koncentrace monoklonálního imunoglobulinu < 30 g/l
- infiltrace kostní dřeně klonálními plazmatickými buňkami < 10 %
- nepřítomnost orgánového poškození myelomem (hyperkalcemie, onemocnění
ledvin, anemie, postižení skeletu) a absence specifických biomarkerů - vyloučení jiného hematologického onemocnění
- Doutnající myelom (smoldering myeloma):
- koncentrace monoklonálního imunoglobulinu > 30 g/l, proteinurie nad
500 mg / 24 h (monoklonální protein) - inifiltrace kostní dřeně klonálními plazmatickými buňkami 10–59 %
- nepřítomnost orgánového poškození myelomem a absence specifických biomarkerů
- Solitární plasmocytom: solitární, medulární nebo extramedulární ložisko
monoklonálních plazmatických buněk bez systémového onemocnění, terapie: ozáření - Leukemie z plazmatických buněk: agresivní forma se špatnou prognózou
- Osteosklerotický MM: POEMS syndrom (polyneuropatie, organomegalie,
endokrinopatie, M-protein, kožní změny [skin]) - AL amyloidóza: způsobená depozicí volných monoklonálních FLC – systémově
v důsledku monoklonální gamapatie (MG) nebo MM či vzácněji B-buněčného
lymfomu, nebo lokálně v důsledku místní produkce FLC. Cirkulující FLC se systémovou manifestací mají přímý kardiotoxický účinek. Deponované FLC vedou k mechanickému poškození všech orgánů mimo CNS a mají cytotoxické a proapoptotické účinky
Diferenciální diagnóza monoklonálních gamapatií

2 Léčba MGRS je zacílena na základní klony B buněk nebo plazmatických buněk a je založena na kombinaci různých chemoterapeutik s cílem zachovat funkci ledvin a zabránit recidivě po transplantaci ledviny (transplantaci ledviny lze provést jen při dosažení
hematologické remise). Pro toto onemocnění neexistují žádná guidelines a byly popsány různé režimy, u některých pacientů byla provedena autologní transplantace kmenových buněk. Klinická praxe se však může řídit rozhodnutím založeným na konsenzu odborníků.
Principy terapie
Aktivní protinádorová léčba:
- Pacienti s asymptomatickým (doutnajícím) MM vyžadují pouze sledování. Zahájení léčby je indikováno u symptomatického MM podle kritérií
Mezinárodní myelomové pracovní skupiny (IMWG). Součástí definice jsou tzv. kritéria CRAB, rozšířená o radiologické a sérologické parametry. Zahájení léčby může urychlit přítomnost některých symptomů a laboratorních projevů - U pacientů vhodných k transplantaci se indukční léčba skládá obvykle z bortezomibu, thalidomidu a dexamethasonu (VTd) či z bortezomibu, lenalidomidu a dexamethasonu (VRd), obou podávaných obvykle ve 4 cyklech,
po nichž následuje autologní transplantace kmenových buněk (ASCT). U vysoce
rizikových pacientů je alternativou k VRd daratumumab, bortezomib, lenalidomid, dexamethason (Dara-VRd). Vybraní pacienti se standardním rizikem mohou dostat další indukční cykly a transplantace může být odložena až do prvního relapsu - Pacienti, kteří nejsou kandidáty transplantace, jsou obvykle léčeni režimem VRd po dobu přibližně 8–12 cyklů a následně lenalidomidem; alternativně mohou být léčeni daratumumabem, lenalidomidem, dexamethasonem (DRd)
- Udržovací léčba: po ASCT potřebují pacienti se standardním rizikem udržovací léčbu lenalidomidem, zatímco u pacientů s MM s vysokým rizikem je nutná udržovací léčba bortezomibem
- Léčba refrakterního onemocnění: většina pacientů vyžaduje při relapsu tripletový režim, přičemž volba režimu se mění s každým dalším relapsem. U vybraných pacientů lze provést druhou autologní transplantaci nebo alogenní PBSCT
- Solitární plazmocytom: operace nebo ozařování a pečlivé sledování progrese do systémového MM. Velké naděje jsou spojovány s buněčnou terapií CAR-T, která ve studiích dosáhla velmi dobré odpovědi a v některých případech i déletrvajících remisí i u pacientů, kteří byli již mnohokrát předléčeni. Důležitými nežádoucími účinky jsou syndrom uvolňování cytokinů, hemofagocytární lymfohistiocytóza / syndrom aktivace makrofágů (HLH/MAS), neurologické nežádoucí účinky a infekce v důsledku protrahované neutropenie
Podpůrná léčba
- Léčba selhání ledvin:
- vhodná hydratace (příjem tekutin > 3 l/d)
- rychlé zahájení léčby myelomu
- eliminace nefrotoxických léků (např. nesteroidních protizánětlivých léků, aminoglykosidů) a kontrastních látek
- léčba hyperurikemie (např. alopurinolem)
- plazmaferéza většinou jen u osob s hyperviskózním syndromem
- event. high cut-off dialýza (při akutním selhání ledvin způsobeném MM a FLC nad 1 000 mg/l)
- Prevence kostních komplikací a léčba osteolýzy je založena na bisfosfonátech podávaných po dobu 2 let nebo déle u pacientů s lytickými lézemi (znovuzahájení léčby v případě progrese onemocnění nebo relapsu). Mezi tyto přípravky patří např. pamidronát nebo zoledronát. Alternativou je denosumab – monoklonální protilátka ze skupiny inhibitorů RANK ligandu, využívaná jinak především k léčbě osteoporózy. U pacientů s kompresivními zlomeninami obratlů je ke zvážení vertebroplastika. Pouze v případě prokázaného deficitu Ca a 25‑OH‑D
je indikována suplementace vápníkem a vitaminem D - Léčba event. hyperkalcemie a hyperkalcemické krize (bisfosfonáty při akutním selhání ledvin a chronickém onemocnění ledvin jen s opatrností)
- Léčba hyperproteinemie a koagulopatie: plazmaferéza se substitucí albuminu nebo koagulačních faktorů (plazmy)
- Léčba symptomatické anemie: erytropoézu stimulující látky (erytropoetin a jeho analoga) nebo transfuze
- Analgetická léčba: paracetamol, opioidy (bez NSA), radioterapie, spondylochirurgický výkon (vertebroplastika)
- Prevence infekcí: vakcinace proti chřipce a pneumokokům; aciklovir u pacientů léčených bortezomibem. U pacientů se závažnými recidivujícími infekcemi podání intravenózního imunoglobulinu nebo subkutánního imunoglobulinu
- Antitrombotická profylaxe: u pacientů léčených thalidomidem nebo lenalidomidem v kombinaci s dexamethasonem kyselina acetylsalicylová
(ASA) 100 mg/d nebo nízkomolekulární heparin (LMWH)
Buněčná terapie CAR-T je protinádorová imunoterapie založená na geneticky modifikovaných T buňkách se syntetickými receptory specifickými pro antigen. CAR je zkratka pro „chimérický antigenní receptor“. Nejprve jsou T buňky odebrány z krve pacienta pomocí leukocytaferézy („sběr“). Je možné použít i alogenní T buňky. T lymfocyty jsou selektovány v laboratoři a klonálně namnoženy pomocí cytokinů (interleukin 2). Poté jsou geneticky modifikovány transdukcí tak, aby na povrchu buněk vytvořily chimérické antigenní receptory, které jsou namířeny proti povrchovým proteinům specifickým pro konkrétní nádorové onemocnění. K tomuto účelu se používají gammaretroviry (RV) nebo lentiviry (LV). Upravené buňky jsou znovu podány pacientovi. Před zahájením léčby CAR-T je třeba provést depleci lymfocytů pomocí chemoterapie. Tím se sníží počet cirkulujících
leukocytů, což stimuluje produkci cytokinů a podporuje expanzi buněk CAR-T. Běžně používanými léky jsou fludarabin a cyklofosfamid. Účinek terapie CAR-T je založen na
tom, že CAR-T buňky rozpoznávají určité antigeny (např. CD19) na nádorových buňkách a svou cytotoxickou aktivitou příslušné buňky ničí. Hlavní výhodou CAR-T oproti nativním T-buněčným receptorům je jejich schopnost rozpoznávat antigeny nezávisle na prezentaci peptidů prostřednictvím molekul MHC I. třídy. Proto mohou být nádorové buňky účinně napadány CAR-T buňkami i v případě, že v rámci imunitního úniku snižují expresi MHC-I. Tímto způsobem lze vybudovat protinádorovou imunitu proti slabě imunogenním nádorům, které by jinak nebyly přístupné imunoterapii. Princip buněčné terapie CAR-T lze v zásadě aplikovat na všechny nádory, které mají dobře definované antigenní vlastnosti vůči zdravým tkáním. Předpokladem je, že proti tomuto antigenu lze vyvinout vhodné protilátky. V současné době (2021) se buněčná terapie CAR-T používá pouze u některých
leukemií a lymfomů vč. MM. U solidních nádorů je využití CAR-T obtížnější. Existuje jen málo cílů, které jsou spolehlivě a specificky exprimovány solidními nádory. Kromě toho musejí buňky CAR-T překonat tkáňové bariéry, aby se dostaly k nádorovým buňkám.
Prognóza
Výsledky léčby MM se liší v závislosti na stagingu a stratifikaci rizika. Celková míra pětiletého přežití je > 45 %. U mladších pacientů léčených optimální terapií (vysokodávkovaná terapie, ASCT, nové substance) činí 10leté přežití přibližně 50 %.
Kazuistika 1
46letá pacientka, dosud bez významných komorbidit, byla asi 4 měsíce léčena pro výrazné bolesti zad. V minulosti tyto potíže nikdy neměla. Vstupně byla vyšetřena praktickým lékařem, který zahájil léčbu bolesti, proběhla rehabilitace s teplými obklady. Stav se však významně nezlepšil. Nemocná dál docházela do práce (pracuje jako pokojská). Poslední tři týdny byly již bolesti nesnesitelné, kvůli pádu na záda si zavolala RZP.
Přijata k hospitalizaci na traumatologii, kde bylo vstupně provedeno CT vyšetření břicha a hrudníku, nebyly zjištěny traumatické změny. Jako vedlejší nález byly popsány difuzní osteolytické postižení skeletu a nejasné změny na ovariu. Byl přizván gynekolog, který gynekologický tumor hodnotil jako nepravděpodobný. Pro suspekci na MM byla pacientka přeložena k dovyšetření na interní oddělení. V laboratoři byl zachycen paraprotein IgG lambda v séru, dále výrazně zvýšená celková bílkovina, zatím bez renální insuficience,
normocytární anemie. Doplněná trepanobiopsie potvrzuje infiltraci plazmocyty, diagnostická kritéria MM byla splněna. Byla zahájena imunochemoterapie dle
protokolu VTd (bortezomib, thalidomid, dexamethason), postupná vertikalizace v korzetu. V plánu 4 cykly této léčby s následnou autologní transplantací krvetvorných buněk.
Z komplementárních vyšetření:
Vstupní laboratoř: S – močovina: 4,6 mmol/ l; S – kreatinin: 82 μmol/l; S – vápník: 2,16 mmol/l; S – celková bílkovina: 126,0 g/l; S – albumin: 25,0 g/l; S – C-reaktivní
protein: < 2 mg/l; S – imunoglobulin A: < 0,1 g/l; S – imunoglobulin G: 94,8 g/l;
S – imunoglobulin M: < 0,1 g/l, S – β2- -mikroglobulin: 3,3 mg/l; S – FLC kappa: 5,16 mg/l; S – FLC lambda: 280 mg/l; S – FLC kappa/FLC, S-Paraprotein IgG typ
lambda: 79 g/l; S – lambda free přítomny; U – celková bílkovina: 1,37 g/l; U – albumin: 32 mg/l; U – paraprotein IgG typ lambda přítomen; U – lambda free přítomny; B – leukocyty str.: 7,80∙109/l; B – erytrocyty str.: 3,03∙1012/l; B – hemoglobin: 99,0 g/l; B – hematokrit: 0,28 l/l; B – trombocyty str.: 224∙109/l. Cytologie kostní dřeně: plazmatické buňky tvoří 28 %, heterogenní, některé mladší či s jadernou inkluzí. Diagnostická kritéria pro MM splněna.
CT hrudníku a břicha s aplikací kontrastní látky: rozšíření a nepravidelná struktura
ventrolaterální partie VII. žebra vpravo tumorózního charakteru. Obdobné rozšíření
a nepravidelná struktura skeletu kaudální poloviny těla sterna se ztenčením kortikalis
rovněž tumorózního charakteru. Hypodenzní ložiska v oblasti skeletu obratlových
těl Th/L páteře výrazně Th3, Th6, Th9, Th10, Th11, Th12 a výrazně i v obratlovém
těle L5 s naznačenou kompresí, drobná ložiska i v ostatních obratlových tělech
L páteře. Postižení obratlového oblouku Th12 vpravo, obratlového oblouku L1
vpravo a transverzálního pravostranného výběžku L5 a rovněž pravostranného
oblouku. Drobná ložiska i v oblasti kostí kyčelních oboustranně.
Kazuistika 2
56letá nemocná byla přijata na traumatologii pro bolesti žeber, které vznikly
následkem minimálního inzultu (přisunula se židlí k desce pracovního stolu). Anamnesticky pobolívání v oblasti levého hemithoraxu několik týdnů. Léčí se s hypertenzí.
V anamnéze dále karcinom cervicis uteri, řešen operačně v roce 2013. Dále karcinom
in situ vulvy, v plánu operační výkon. Dle rentgenu byla popsána sériová fraktura levostranných žeber s dislokací (V., VIII.–X.). Laboratorně při přijetí výrazná
leukocytóza, v diferenciálním rozpočtu 51 % plazmatických buněk, renální insuficience,
hyperkalcemie. Vstupně zahájena léčba bisfosfonáty, parenterální hydratace.
Cytologicky z kostní dřeně byla potvrzena diagnóza symptomatického MM, vstupně
ve formě plazmocelulární leukemie, klinické stadium IIIB dle SD, 3 dle ISS. Zahájena
terapie dle protokolu BDd (bortezomib, doxorubicin, dexamethason). Celkem podány 3 cykly s dosažením celkové remise (došlo k vymizení plazmatických buněk
z periferní krve). V počátku byla léčba přerušena pro onemocnění covid-19, které však mělo lehký průběh. Před transplantací proběhlo chirurgické řešení karcinomu vulvy. Následně na vyšším pracovišti proběhly v rozmezí 4 měsíců dvě autologní transplantace krvetvorných buněk s následnou alogenní nepříbuzenskou transplantací kostní dřeně od 33letého HLA shodného muže.

Z komplementárních vyšetření:
Vstupní laboratoř: S – močovina: 25,1 mmol/l; S – kreatinin: 311 μmol/l; S –
kyselina močová: 784 μmol/l; S – draslík: 4,01 mmol/l; S – vápník: 4,58 mmol/l;
S – ca korig. na albumin: 4,35 mmol/l; S – celková bílkovina: 72,0 g/l; S –
albumin: 53,0 g/l; S – C-reaktivní protein: 5,4 mg/l; S – FLC kappa: 35,00 mg/l;
S – FLC lambda: 6,78 mg/l; S – FLC kappa/FLC lambda: 5,16; B – leukocyty
str.: 69,60∙109/l; B – erytrocyty str.: 3,90∙1012/l; B – hemoglobin: 126,0 g/l;
B – hematokrit: 0,36 l/l; B – stř. obj. erytr. 93,5 fl; B – trombocyty str.: 141∙109/l;
B – Bblast: 1,0 %; B – plazmatická buňka: 51,0 %. Imunofenotypizace periferní krve:
daným imunofenotypizačním panelem bylo zjištěno asi 70 % buněk plazmocytárního
charakteru, imunofenotypově se jedná nejspíše o plazmocytární myelom (plazmocytární leukemie). Cytologie z kostní dřeně: plazmatické buňky: 22 % – výrazně zmnoženy, s jadérky, místy i vícejaderné.
Kazuistika 3
72letý nemocný byl přivezen RZP na interní příjem. V den přijetí byly dopoledne provedeny odběry krve na gastroenterologii, kde dominoval obraz renální insuficience.
Anamnesticky asi tři měsíce nechutenství, za toto období váhový úbytek asi 8 kg.
Pacient se cítí slabý a nevýkonný. Nezvracel, neměl průjem ani zácpu, bez bolestí. Praktickým lékařem byl odeslán na gastroskopii. Zde bez patologie v endoskopickém
obraze.
Dále měl v poslední době dva pády na kole, jednou se udeřil do podžebří zepředu
vlevo, pak si přivodil kontuzi levé kyčle. Ve vstupní laboratoři urea 51,7 mmol/l,
kreatinin 926 μmol/l, hyperkalemie 6,66 mmol/l, elevace CRP – 81,9, v krevním
obraze normocytární anemie s Hb 114 g/l. Kultivační vyšetření moči negativní.
Na RTG S + P bez průkazu ložiskových či infiltrativních změn v plicním parenchymu,
beze známek městnání v malém oběhu. Na UZ břicha věku přiměřený nález, normální
velikost ledvin. Zaveden dialyzační CŽK, zahájena hemodialýza.
Doplněno UZ renálních cév – neprokázána cévní etiologie akutního selhání ledvin,
renální tepny a žíly volné, těžce patologické intrarenální toky typické pro kompletní
afunkci ledvin. U pacienta zjištěna vysoká hladina FLC v patologickém poměru.
Provedena trepanobiopsie – cytologicky z kostní dřeně potvrzena diagnóza MM.
Dále dialyzován pomocí high cut-off membrán. Na RTG skeletu neprokázány osteolytické ložiskové změny. Vzhledem k diagnóze symptomatického MM hematologem indikována terapie dle protokolu VTd (bortezomib, thalidomid, dexamethason)
a autologní transplantace periferních kmenových buněk. Pro animizaci podávány ERD, nastavena léčba hypertenze. Pokračováno v pravidelném HD programu. Při zavedené léčbě stav pacienta zlepšen, ústup celkové slabosti a únavy. Renální insuficience zatím přetrvává, pacient dependentní na hemodialýze.

Z komplementárních vyšetření:
Vstupní laboratoř: S – močovina: 51,7 mmol/l; S – kreatinin: 926 μmol/l; S –
draslík: 6,66 mmol/l; S – chloridy: 111 mmol/l; S – vápník: 2,31 mmol/l; B – leukocyty str.: 9,30∙109/l; B – erytrocyty str.: 3,80∙1012/l; B – hemoglobin: 114 g/l; B – hematokrit: 0,33 l/l; B – trombocyty str.: 180∙109/l; S – FLC kappa: 2670,00 mg/l; S – FLC lambda: 501,00 mg/l; S – FLC kappa/FLC lambda: 5,33. RTG vyšetření skeletu páteře a dlouhých
kostí neprokázálo osteolytické změny.
Cytologie z kostní dřeně:
plazmatické buňky: 16 %, převažují zralé formy, přítomno i několik dvoujaderných buněk.
Závěr
Navzdory pokrokům v léčbě většina pacientů s diagnózou MM umírá na následky
svého onemocnění. Pacienti mohou být léčeni několika liniemi terapie, ale trvání remise se obvykle s každým relapsem snižuje a nemoc se nakonec stává refrakterní. Konečné stadium onemocnění může způsobit řadu problémů včetně bolesti kostí, selhání ledvin, selhání kostní dřeně a infekcí, což je často konečnou příčinou úmrtí pacientů s MM. Nové léčebné postupy, některé zavedené do praxe již letos (CAR-T buněčné terapie), pravděpodobně dramaticky zlepší prognózu tohoto onemocnění.
Pro lékaře nezabývající se léčbou myelomu je nutné především na možnost onemocnění myslet, správně indikovat a posléze interpretovat základní vyšetření
(včetně ELFO bílkovin, Ca, FW). Stanovení všech těchto parametrů je dostupné a nenáročné, avšak je také často opomíjeno. Vyšetření těchto laboratorních parametrů přitom může zásadně přispět k rychlejšímu stanovení správné diagnózy, a tím i zlepšení prognózy pacientů.
Literatura na
www.actamedicinae.cz/literatura
MUDr. Vít Motáň / Transfuzní oddělení,
Oddělení klinické hematologie,
Nemocnice České Budějovice, a. s.
MUDr. Jan Vachek / Klinika nefrologie
1. LF UK a VFN, Praha, Interní oddělení
a hemodialyzační středisko,
Klatovská nemocnice, a. s.