Screening kolorektálního karcinomu
Zhoubné nádory tlustého střeva a konečníku, především kolorektální karcinom (KRCA), jsou druhým nejčastějším zhoubným nádorem v Evropě a druhou nejčastější příčinou úmrtí na nádorová onemocnění. V České republice bylo v roce 2017 diagnostikováno 7 439 pacientů s KRCA a 3 685 osob na toto onemocnění zemřelo, většina ve stádiu Dukes III–IV. Proces kancerogeneze trvá v průměru 8–10 let, kvalitně provedeným screeningem je proto možné zachytit premaligní stádia, především polypy – adenomy, a jejich včasným odstraněním zabránit vzniku karcinomu [1]. Screening zhoubných nádorů tlustého střeva a konečníku je spolu se screeningem karcinomu prsu a děložního hrdla součástí národních programů onkologického screeningu v souladu s doporučením Rady Evropské unie z 2. 11. 2003. Kvantitativní FIT test pro okultní krvácení je v současné době optimálním primárním testem pro screening KRCA. Dosavadní důkazy naznačují, že okultní krvácení testované pomocí FIT zůstane nejlepším testem pro populační screening KRCA v příštím desetiletí [2]. Kvantitativní FIT nabízí významnou možnost zahrnující hodnoty FIT testu do rizika algoritmu KRCA screeningu a pro personalizaci screeningových programů.
Kvantitativní FIT test pro okultní krvácení
Senzitivita gFOBT pro detekci kolorektálních karcinomů se pohybuje kolem 30 %, zásadní výhodou gFOBT byla však jejich téměř nulová falešná pozitivita při téměř 100% specificitě. Rozhodnutím Komise pro screening KRK MZ ČR ze dne 2. července 2012 byl gFOBT test pro okultní krvácení při screeningu KRCA nahrazen imunochemickými testy iFOBT (FIT), a to jak kvalitativními rapid testy, tak kvantitativní analýzou hemoglobinu [3]. Analýzou screeningových dat za rok 2016 byla zjištěna průměrná pozitivita FIT 7,2 % s velmi vysokou variabilitou mezi regiony v České republice – 4,0 až 13,3 %. Zahraniční studie použití rapid testů pro screening KRCA zásadně nedoporučují [4] a analýza externí kontroly kvality provedená na souboru 1 250 účastníků v Koreji vykazuje srovnatelná data se screeningem v ČR [5]. Rozhodnutím Komise pro screening KRK MZ ČR byl schválen text aktualizovaného Věstníku MZ ČR pro screening KRCA a screeningovou metodou bude od ledna 2020 pouze kvantitativní imunochemický test (FIT) ověřený externí kontrolou kvality. Touto zásadní změnou dochází k výraznému zpřesnění pozitivity FIT.
Optimalizace screeningu KRCA
Optimalizace screeningu KRCA zahrnuje nejen odborná zdravotnická hlediska, ale také aspekty epidemiologické, ekonomické a organizační, jako je například dostupnost screeningové kolonoskopie. Většina studií byla v předchozích letech zaměřena na optimalizaci hodnoty cut-off FIT testu [6] nebo na provedení více testů místo jednoho (obrázek č. 1), vzhledem k tomu, že adenomy krvácejí intermitentně a dříve používaný guajakový test se prováděl standardně ve třech po sobě jdoucích stolicích [7]. Požadavek dostupnosti screeningové kolonoskopie je řešen v mnoha studiích. Holandská práce Wietena [8] zdůrazňuje, že počet endoskopií lze snížit o 14 nebo 11 % zvýšením věkové hranice z 50 na 55 let nebo zvýšením cut-off z 10 µg/g na 15 µg/g, přičemž by počet nalezených adenomů klesl pouze o 9 nebo 6 %.

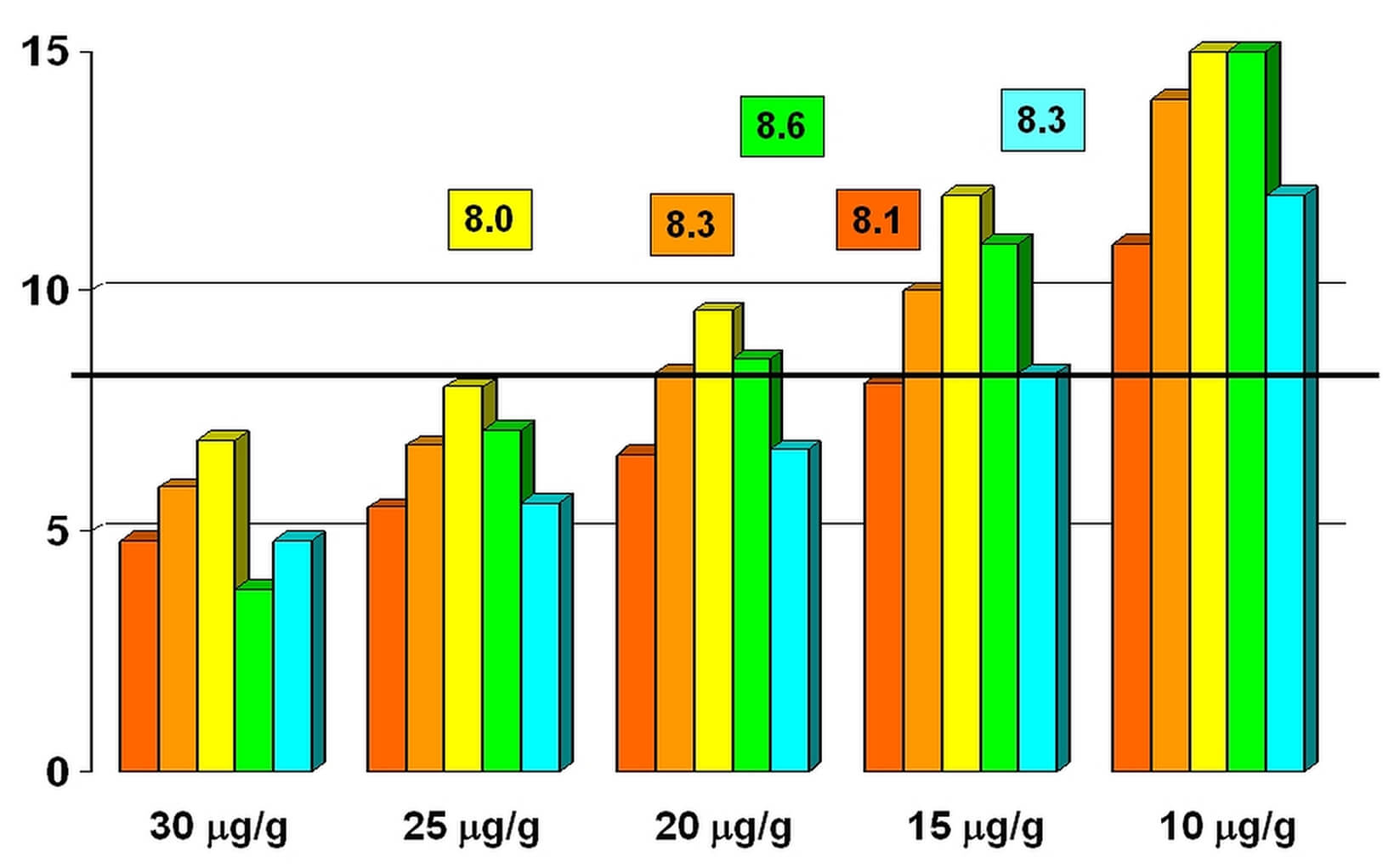
Obrázek č. 1
Diagnostický přínos zachycení pokročilých neoplasií na 1 000 osob podle studie Kapidzic [7] při provedení: jednoho FIT testu 1× (žlutá), jednoho FIT testu 2× (světle oranžová), dvou FIT testů 1× (tmavě oranžová) a dvou FIT testů 2× (červená).
Personalizace screeningu KRCA
Screening rakoviny tlustého střeva a konečníku může zachránit životy, je ale třeba cíleného osobního neboli personalizovaného screeningu. Aktuální studie zkoumají individuální posouzení rizik na základě rodinné historie, životního stylu a environmentálních a genetických faktorů. Kvantitativní analýza hemoglobinu ve stolici, tedy hodnoty FIT a jejich změny v čase, jsou jedním z faktorů pro identifikaci pacientů s vysokým rizikem vzniku KRCA. Základními cíli personalizovaného screeningu je snížení zatížení screeningu, využívání omezených zdrojů, nákladů a samozřejmě výskytu a úmrtnosti na KRCA [9]. Věkový interval doporučený pro screening KRCA asymptomatických osob je při personalizovaném přístupu řešen individuálně. Doporučení publikované ve Spojených státech amerických v roce 2018 posunulo screening KRCA již od 45 let [10]. Na něj bezprostředně reagoval Imperiale [11], který zdůrazňuje neschopnost integrovat další faktory do personalizovaného screeningu (pohlaví, příbuznost prvního stupně s KRCA, vysoký index tělesné hmotnosti, metabolický syndrom, kouření cigaret, strava, užívání určitých léků, hormonální substituční terapie). Inteligentní hodnocení FIT testů by mělo rovněž zahrnovat variabilitu FIT hodnot, které se liší podle věku a pohlaví. Studie provedená v Kaiser Permanente (USA) na souboru 640 859 osob [12] deklaruje doporučené cut-off při zvolené pozitivitě 8 % následovně: muži 20 µg/g, ženy 15 µg/g, 50–59 let 15 µg/g, 60–69 let 20 µg/g, 70–75 let 25 µg/g (obrázek č. 2).
Obrázek č. 2
Pozitivita FIT testu pro cut-off v rozmezí: 10–30 µg/g pro muže (zelená), ženy (modrá), ve věku 50–59 let (tmavě oranžová), 60–69 let (světle oranžová) a 70–75 let (žlutá). Hodnoty v rámečku označují personalizované cut-off při nastavení pozitivity na 8 %, podle studie Selby [12].
Riziko vzniku KRCA
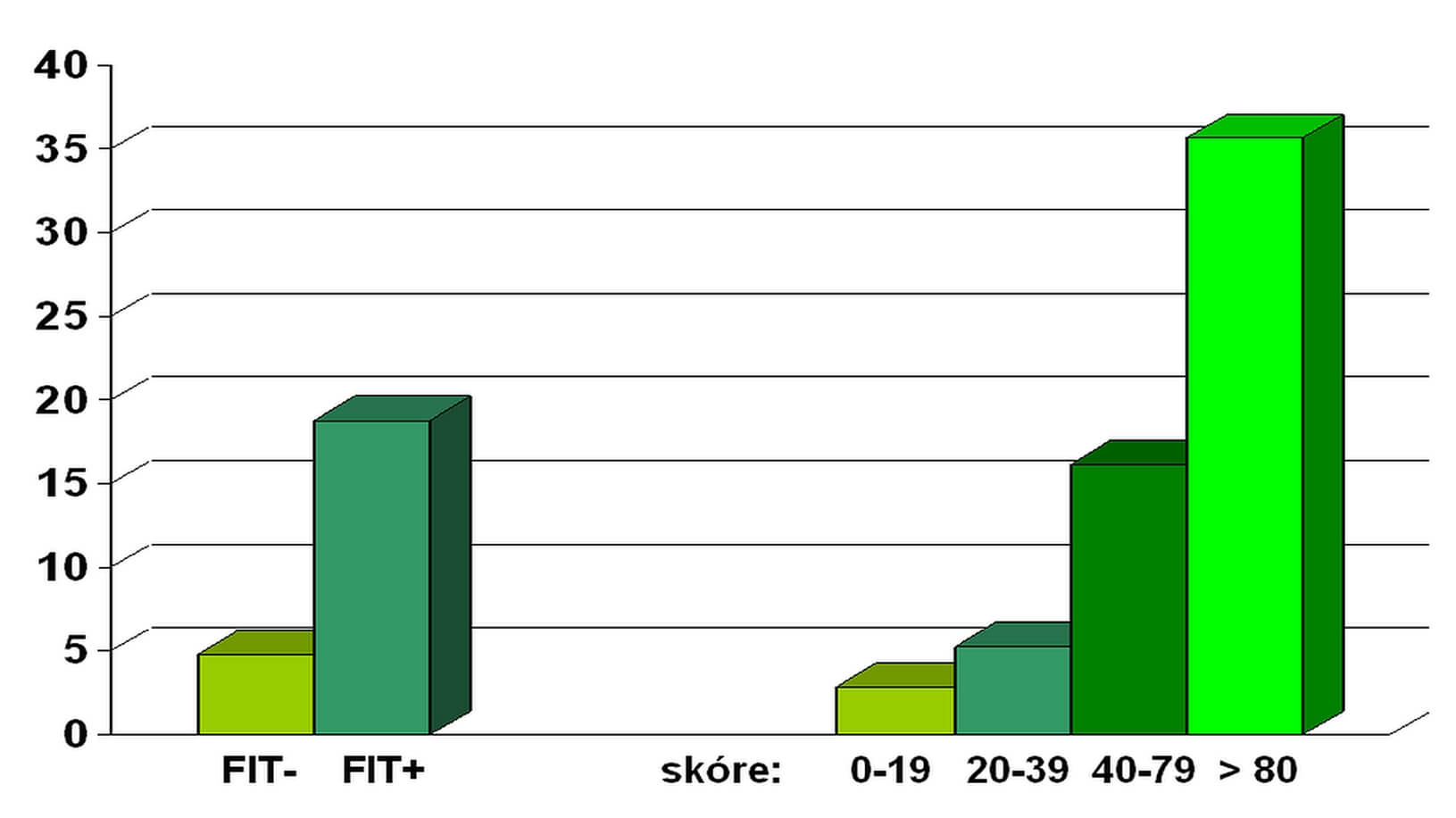
Riziko vzniku kolorektálního nádoru, čili jeho predikce, je dalším prvkem personalizace screeningu. Studie Colonpredict [13] zahrnuje do vícerozměrného modelu 11 proměnných s následující faktory rizika: věk (1,04), mužské pohlaví (2,2), Hb ve stolici ≥ 20 μg/g (17,0), Hb v krvi <10 g/dl (4,8), CEA ≥ 3 ng/ml (4,5), předchozí kolonoskopie (0,1), krvácení z rekta (2,2) a změna střevní pasáže (1,7). Přínos výpočtu rizika srovnává Park. [14] Procento nalezených pokročilých kolorektálních neoplasií metodou FIT při cut-off 20 µg/g stolice – 18,8 % s výpočtem rizika zahrnující FIT, věk, pohlaví, obezitu, kouření a diabetes. Při hodnotě rizikového skóre nad 80 je diagnostický přínos téměř dvojnásobný – 35,7 % (obrázek č. 3). Zvýšené riziko vzniku KRCA je popsáno nejen u IBD, diabetiků 2. typu, ale také u metabolického syndromu [15].
Obrázek č. 3
Diagnostický přínos zachycení pokročilých neoplasií personalizovanou analýzou rizika KRCA zahrnující FIT, věk, pohlaví, obezitu, kouření a diabetes (skóre rizika KRCA 0–20–40–80) proti metodě detekce FIT při cut-off 20 µg/g stolice (FIT negativní a FIT pozitivní) podle studie Park [14].
FIT v diagnostice symptomatických osob
Význam nízkých hodnot Hb (negativních FIT testů) zdůrazňuje holandská studie [16]. Po 8 letech sledování měli účastníci s výchozími koncentracemi hemoglobinu 8–10 µg/g vyšší kumulativní výskyt pokročilých neoplazií (33 %) než účastníci s nulovou hodnotou hemoglobinu (5 %). Účastníci se dvěma po sobě následujícími koncentracemi 8 µg/g měli ve srovnání s účastníky se dvěma po sobě jdoucími nulovými koncentracemi hemoglobinu ve stolici čtrnáctinásobné zvýšení rizika pokročilé neoplazie. Výchozí a následné koncentrace hemoglobinu ve stolici byly vyhodnoceny jako nezávislé prediktory pro rozvoj pokročilých neoplazií. Tyto informace by měly být použity při navrhování personalizovaných strategií pro KRCA screening. Rozsáhlá studie NHS z května 2017 [17] analyzuje na 271 stranách efektivitu automatizovaných laboratorních FIT testů, (Eiken, Japonsko), HM-JACKarc (Kyowa Medex, Japonsko), FOB Gold (Sentinel, Itálie), komplex Ridascreen Hb/Ht (R-Biopharm, Německo), pro primární péči a osoby s nízkorizikovými příznaky KRCA. Studie sumarizuje závěry tak, že imunochemické testy hemoglobinu ve stolici jsou pravděpodobně klinicky i ekonomicky efektivní strategií pro třídění osob, které se v primární péči prezentují s příznaky dolní části zažívacího ústrojí při současně nízkém riziku kolorektálních nádorů.
Laboratorní aspekty FIT testů
Kvantitativní FIT test pro okultní krvácení je metodou imunologickou a hodnoty koncentrace hemoglobinu ve stolici jsou stanoveny ve vztahu na kalibraci analyzátoru, mohou se proto lišit při stanovení na různých analytických systémech. Kritérium cut-off 15 µg/g stolice bylo v Holandsku zvoleno na základě mnoha studií provedených s analyzátorem OC-Sensor a předpokládaná pozitivita měla být 6,3 %. Screening KRCA je však prováděn testem FOB Gold, který byl zvolen pro populační screening v Holandsku na základě výběrového řízení, skutečná pozitivita po 1 roce (12,2 %) výrazně zvýšila potřebu kolonoskopií a vedla k nutnému zvýšení cut-off kritéria na 47 µg/g při snížení citlivosti metody a pozitivity testu na očekávaných 6,3 %. Na letošním meetingu WEO CRC Screening Committee v Barceloně porovnávala Lansdorp-Vogelaar variantu nejúčinnějšího screeningu (FIT ročně, 45–80 let, 10 µg/g) s aktuálně realizovaným screeningem (FIT 1× za 2 roky, 55–75 let, 47 µg/g) se závěrem snížení nároku na kolonoskopie <třetina efektu oproti nejúčinnějšímu screeningu [18].
Rozdílná pozitivita FIT ve vztahu k technologii analytického procesu je podrobně popsána v německé studii [19] analyzující 9 rozdílných kvantitativních metod stanovení hemoglobinu ve stolici. Autoři porovnali tři varianty pro nastavení cut-off kritéria. Je-li nastaveno cut-off doporučené výrobcem, OC Sensor 10 µg/g, SENTiFIT FOB Gold 17 µg/g, CAREprime Hb 6,3 µg/g, QuikRead Go iFOBT 15 µg/g a Eurolyser FOB test 8,04 µg/g, pak je pozitivita testu 6,8–6,2–12,3–6,8–5,7 %. Při shodně nastavené cut-off na 15 µg/g je pozitivita pro tyto analyzátory 3,4–6,6–5,6–5,9–4,0 %, a je-li nastavena shodná specificita na 96,7 %, pak je téměř shodná pozitivita mezi 5,9–6,1 %. Pro každý analyzátor je ale nutné volit specifické cut-off – OC Sensor 6,6 µg/g, SENTiFIT-FOB Gold 17,68 µg/g, CAREprime Hb 12,35 µg/g, QuikRead Go iFOBT 15 µg/g a Eurolyser FOB test 6,11 µg/g. Na letošním meetingu WEO CRC Screening Committee v Barceloně prezentovala Ulrike Haug analýzu 2,8 milionů FIT provedených v Německu v roce 2018 technologiemi 12 různých výrobců, kdy nebylo definováno cut-off, ale požadavek na metodu, a to 25% senzitivita pro záchyt pokročilé neoplasie a >90% specificita FIT testu. Závěry podstatné pro náš český screening – metoda OC-Sensor provedená u 1 347 061 osob, cut-off 10 µg/g, měla pozitivitu 10,2 %. Metoda FOB Gold provedená u 532 133 osob, cut-off 17 µg/g měla pozitivitu 7,9 % [20].
Kam směřuje screening KRCA
Česká společnost klinické biochemie (ČSKB) zpracovala v roce 2015 doporučení pro stanovení okultního krvácení a screening v České republice kvantitativní analýzou s výsledky v jednotkách µg Hb/g stolice [21]. Tato metoda bude primární screeningovou metodou v ČR od ledna 2020. Evropská doporučení nyní řeší personalizovaný přístup [22], který nás čeká v dalších letech. Personalizaci screeningu KRCA budeme řešit, předpokládám, postupně. Prvním, nejjednodušším krokem, by mohlo být inteligentní vyhodnocení FIT testu na základě věku a pohlaví, které umí řešit každý laboratorní informační systém, včetně variability technologií, které budeme v Česku používat. Dalším krokem bude variabilita doporučeného věku pro screening zahrnující rodinnou historii, životní styl a environmentální a genetické faktory ve vztahu ke kvantitativním hodnotám koncentrace hemoglobinu ve stolici. Posledním krokem bude integrace analýzy FIT a výpočtu rizika vzniku KRCA nejen v asymptomatické populaci, ale rovněž u symptomatických osob v gastroenterologii, nemocných a dispenzarizovaných, kdy by průběžně prováděný FIT test mohl být jedním z kriterií pro včasnou detekci intervalových karcinomů. V personalizovaném přístupu ke screeningu KRCA výrazně vzroste role praktických lékařů, protože právě oni mají znalosti rodinné historie, životního stylu, a dalších environmentálních a genetických faktorů pro posouzení rizika vzniku KRCA.
Literatura
- ZAVORAL M., VOJTĚCHOVÁ G., MÁJEK O., et al. Populační screening kolorektálního karcinomu v České republice. Časopis lékařů českých 2016; 155: 7–12
- BENTON SC., SEAMAN HE., HALLORAN SP.: Faecal Occult Blood Testing for Colorectal Cancer Screening: the Past or the Future. Curr Gastroenterology Rep 2015; 17(2): 428
- SEIFERT B., KORCOVÁ M., KRÁL N. Variabilita testů na okultní krvácení používaných praktickými lékaři ve screeningu kolorektálního karcinomu v České republice. Gastroent Hepatol 2015; 69 (3): 255–258
- HAUG U., BECKER N. Immunochemical fecal occult blood tests for colorectal cancer screening: Point-of-care tests are not tenable for a quality-assured program. Dtsch med Wochenschr 2016; 141 (10): 729–731
- CHANG-HO JEON, A-JIN LEE. Annual report on the external quality assessment scheme for urinalysis and faecal occult blood testing in Korea. J Lab Med Qual Assur 2016; 38: 120–128
- TERHAAR SIVE DROSTE JS, OORT FA., VAN DER HULST RW et al.: Higher fecal immunochemical test cutoff levels: lower positivity rates but still acceptable detection rates for early-stage colorectal cancers. Cancer Epidemiol Biomarkers Prev. 2011; 20(2): 272-280
- KAPIDZIC A, VAN ROON AHC, VAN LEERDAM ME, et al.: Attendance and diagnostic yield of repeated two-sample faecal immunochemical test screening for colorectal cancer. Gut. 2017; 66(1):118-123
- WIETEN E, SCHREUDERS EH, NIEUWENBURG SA, et al. Effects of increasing screening age and fecal hemoglobin cut-off concentrations in a colorectal cancer screening program. Clin Gastroenterol Hepatol 2016; 14 (12): 1771–1777
- KUIPERS EJ, SPAANDER MC.: Personalized screening for colorectal cancer. Nature Rev.Gastro.Hepato. 2018; 15: 391–392
- WOLF AMD, FONTHAM ETH, CHURCH TR et al.: Colorectal cancer screening for average-risk adults: 2018 guideline update from the American Cancer Society. CA Cancer J Clin. 2018; 68 (4): 250–281
- IMPERIALE TF, KAHI CJ, REX DK.: Lowering the Starting Age for Colorectal Cancer Screening to 45 Years: Who Will Come…and Should They? Clin Gastroenterol Hepatol. 2018 (10): 1541–1544
- SELBY K, JENSEN CD, LEE JK et al.: Influence of Varying Quantitative Fecal Immunochemical Test Positivity Thresholds on Colorectal Cancer Detection. Ann Intern Med. 2018; 169 (7): 439–447
- CUBIELLA J, VEGA P, SALVE M. et al.: Development and external validation of a faecal immunochemical test-based prediction model for colorectal cancer detection in symptomatic patients. BMC Medicine 2016, 14: 128
- PARK CH, JUNG YS, KIM NH, et al.: Usefulness of risk stratification models for colorectal cancer based on fecal hemoglobin concentration and clinical risk factors. Gastrointest Endosc. 2019 Jun; 89(6): 1204–1211
- ULAGANATHAN V, KANDIAH M, MOHD SHARIFF Z.: A case-control study of the association between metabolic syndrome and colorectal cancer: a comparison of International Diabetes Federation, National Cholesterol Education Program Adults Treatment Panel III, and WHO definitions. J Gastrointest Oncol. 2018; 9(4): 650–663
- GROBBEE EJ, SCHREUDERS EH, HANSEN BE et al.: Association Between Concentrations of Hemoglobin Determined by Fecal Immunochemical Tests and Long-term Development of Advanced Colorectal Neoplasia. Gastroenterology. 2017; 153(5): 1251–1259
- WESTWOOD M, CORRO RAMOS I, LANG S. et al.: Faecal immunochemical tests to triage patients with lower abdominal symptoms for suspected colorectal cancer referrals in primary care: a systematic review and cost-effectiveness analysis. Health Technol Assess. 2017; 21(33): 1–234
- LANSDORP-VOGELAAR I.: Optimal FIT Screening for Men and Women in Case of Limited Colonoscopy Capacity: A Cost-Effectiveness Analysis. WEO CRC Screening Committee, FIT for Screening, Barcelona, October 2019
- GIES A, CUK K, SCHROTZ-KING P, BRENNER H.: Direct Comparison of Diagnostic Performance of 9 Quantitative Fecal Immunochemical Tests for Colorectal Cancer Screening. Gastroenterology 2018; 154: 93–104
- HAUG U.: Update on CRC screening in Germany. WEO Colorectal Cancer Screening
Committee, Barcelona, October 2019 - KOCNA P, ZIMA T. Doporučení České společnosti klinické biochemie ke správnému používání metody stanovení okultního krvácení ve stolici. Tempus medicorum 2015; 24(10): 30–31
- HELSINGEN LM, VANDVIK PO, JODAL HC.: Colorectal cancer screening with faecal immunochemical testing, sigmoidoscopy or colonoscopy: a clinical practice guideline. Practice Rapid Recommendations. BMJ 2019; 367 (ePub. l5515)
Autor:
MUDr. Petr Kocna, CSc.
Ústav lékařské biochemie a laboratorní diagnostiky, 1. LF UK a VFN Praha