Autoři: Mgr. Jitka Fojtů1, MUDr. Milan Zlámal2, Mgr. Magdalena Uzlíková, Ph.D.1, Mgr. Olga Svobodová1 a RNDr. Antonín Valkoun, CSc. 1
1 synlab czech s.r.o., Laboratoř CUBE, Evropská 178, Praha 6
2 Klinika infekčních nemocí 1.LF UK, ÚVN, U Vojenské nemocnice 1200, Praha 6
Leptospiróza je typická antropozoonóza. Je známo více než 250 kmenů. Přenáší se vodou, která byla kontaminována močí a výkaly infikovaných zvířat. Každý kmen má svého hlavního a potencionálního zvířecího hostitele, a pokud byl pacient ve styku s takovým zvířetem nebo jeho výměšky, můžeme na zdroj poukázat a provést patřičná opatření. V České republice je incidence leptospirózy vyšší v letních a podzimních měsících a zároveň je riziko nákazy vyšší při záplavách. Bránou infekce jsou sliznice – či, nos, ústa a různá poranění kůže. Inkubační doba je 2–21 dní (1). Onemocnění často připomíná chřipku a obvykle začíná horečkou.
Po snížení teplot obvykle nastupuje druhá fáze onemocnění, kdy dochází k orgánovému poškození. Často jsou zasaženy játra, ledviny a nervová soustava.
Laboratorní diagnostika
Laboratorní diagnostika leptospirózy je v současnosti založena na kombinaci detekce protilátek a přímé diagnostiky molekulárními metodami. Pro nepřímou diagnostiku se využívá mikroskopický aglutinační test (MAT), jehož principem je reakce specifické protilátky obsažené v pacientově séru s živými kmeny leptospir. Protilátky se v séru objevují obvykle mezi 3. a 10. dnem od projevu příznaků (1, 3), a proto se doporučuje odebírat párové sérum. První sérum se odebírá obvykle v prvním týdnu onemocnění, a pokud je to možné, doporučuje se odebrat párové sérum s odstupem 7–14 dnů (2), což již umožňuje stanovit kmen leptospir, který je původcem onemocnění. Párové sérum také umožňuje na základě dynamiky titrů protilátkové odpovědi odlišit, zda se jedná o akutní fázi infekce nebo o protilátky po infekci prodělané v minulosti.
V naší laboratoři používáme pro diagnostiku 9 kmenů, které reprezentují zástupce vyskytující se na území České republiky. Tyto živé kmeny se inkubují spolu s naředěným sérem pacienta v mikrotitrační destičce. Výsledek reakce se hodnotí mikroskopicky v zástinu. Pokud jsou v séru pacienta přítomné protilátky, dochází k aglutinaci a lyzi leptospir. Dojde-li u některého kmene k lyzi leptospir, provádíme dotitrování při vyšších ředěních séra. V bodě, kdy lyze leptospir dosáhne 50 %, se tento titr uvádí jako pozitivní výsledek.
PCR diagnostika leptospirózy umožňuje rychlý a citlivý průkaz leptospir v pacientských vzorcích v počátcích onemocnění. Dostupné jsou komerční kity založené na detekci různých genů specifických pro rod Leptospira. V prvním týdnu od projevů onemocnění lze zachytit leptospiry v nesrážlivé krvi, po týdnu také v moči. U pacientů se symptomy meningitidy jsou leptospiry detekovatelné v likvoru. PCR je možné využít i pro další klinické materiály, jako jsou jaterní nebo ledvinové biopsie (2, 3). V naší laboratoři používáme pro izolaci RNA kit QIAamp® RNA Blood Mini Kit (Qiagene), pro reverzní transkripci a následující PCR reakci kit Leptospira 16S RNA Real-TM (Sacace), který umožňuje kvalitativní stanovení. PCR probíhá na přístroji Rotor-Gene Q (Qiagene) a příslušným softwarem jsou vyhodnoceny výsledky.

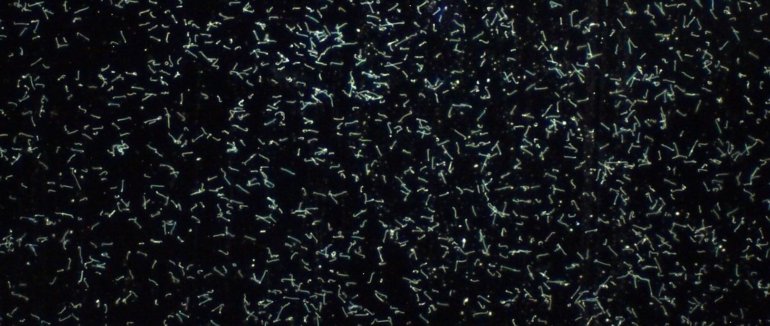
Obr. 1: L. icterohaemorrhagiae – MAT negativní,
intaktní a živě pohyblivé leptospiry (zástin,
blesk). Měřítko 100 μm.
Kazuistika
V našich laboratořích jsme měli možnost provést simultánní vyšetření MAT a PCR několika pacientů s akutně probíhající leptospirózou. Zde uvádíme hodnoty dvou případů, u kterých máme k dispozici více dat.
V prvním případě se jednalo o pacienta (ročník 1986), který hledal kešku (geocaching – zážitková geohra) v kanále a náhle přišla bouře, která ho v kanále zaplavila. Pacient se zranil na hlavě, kudy pravděpodobně pronikly leptospiry. Také se vody z kanalizace při této živelné události při tonutí napil. Po 12 dnech se objevily první obtíže. Teplota až 39°C, celková slabost, zimnice, myalgie a nechutenství. Občas se vyskytla bolest hlavy za čelem. Pro tento septický stav byl přijat na akutní lůžko. Vzhledem k typickým laboratorním hodnotám (renální postižení, hepatální léze) a anamnéze tonutí v kanalizaci bylo na leptospiry již při přijetí pomýšleno. První vzorek moči na PCR diagnostiku byl do naší laboratoře zaslán 17 dní po nákaze.
Za dalších 6 dní (23 dní po nákaze) jsme v laboratoři obdrželi také sérum pro stanovení protilátek metodou MAT, při kterém byla zjištěna pozitivní reakce u třech kmenů (Tab. 1). Za dalších 14 dní bylo vyšetření metodou MAT opakováno a určen vůdčí kmen, L. icterohaemorrhagiae – původce Weilovy žloutenky, jehož hlavním rezervoárem je potkan (Rattus norvegicus), který se v kanalizaci běžně vyskytuje a je známo (4), že potkani jsou často na tuto leptospiru pozitivní a lze předpokládat, že svou močí vodu v kanále kontaminovali. Pacient byl vyléčen ceftriaxonem 2g/24h i.v. podávaném po 8 dní.
Negativní a pozitivní reakce metodou MAT jsou vyobrazeny na obrázcích 1 a 2.
Ve druhém případě se jednalo o pacienta (ročník 1970), který byl přijat na akutní standardní lůžko pro septický stav provázený horečkami až 39°C se zimnicí, slabostí, bolestmi kloubů, svalů a břicha. Udával také dysurie. Měl nauzeu a zvracel. Při přijetí bylo vstupně provedeno sono břicha bez akutní patologie, rentgen plic s normálním nálezem, moč byla chemicky negativní. Fokus nebyl vstupně nalezen. V laboratoři byly vysoké markery zánětu a lehká hepatální léze s mírnou elevací kreatininu. Empiricky byl po odběru biologického materiálu k mikrobiologickým vyšetřením ihned zajištěn intravenózně podaným ceftriaxonem v dávce 2 gramy. Toto antibiotikum bylo zvoleno jako empirická léčba komunitní sepse. Po podání antibiotika došlo k bouřlivé Jarisch-Herxheimerově reakci s nutností obnovení vitálních funkcí (kardiopulmonální resuscitace). Pacient byl přeložen na resuscitační lůžko. Zde byla antibiotická terapie eskalována na meropenem 2g/8h spolu s vankomycinem i.v. Vzhledem k sezóně a v rámci diferenciální diagnostiky bylo ošetřujícím lékařem indikováno i laboratorní vyšetření leptospirózy. V naší laboratoři jsme první materiál obdrželi po 4 dnech od prvních obtíží, které bylo možno vztáhnout k počínající leptospiróze. Pomocí MAT jsme určili hraniční hodnotu u jednoho kmene – L. bataviae (Tab. 2). Zároveň byla potvrzena pozitivita metodou PCR. Po následujících 12 dnech byl vyšetřením párového séra jako původce onemocnění prokázán kmen L. grippotyphosa a spolu s ním aglutinovaly další tři kmeny s hraničními hodnotami. Poslední vzorek jsme pak vyšetřili po 35 dnech od prvních příznaků, kde je vidět již mírně klesající hodnota titru. Pacient byl dále léčen 5 dní ceftriaxonem 2g/24h a dále azitromycinem per os.

Obr. 2
L. icterohaemorrhagiae – MAT pozitivní,
lyzované a aglutinované leptospiry
(zástin, blesk). Měřítko 100 μm.
Diskuse a závěr
Leptospiróza může být i v dnešní době závažným onemocněním, a proto je spolehlivá diagnostika velmi žádoucí. Požadavek na diagnostiku leptospirózy není v naší laboratoři ničím neobvyklým, zejména v letních měsících, kdy je pravděpodobnost infekce vyšší. Častým jevem vyskytujícím se u vyšetření metodou MAT u pozitivních pacientů je přítomnost tzv. paradoxní reakce, kdy kmen, který nemoc způsobil, má nejdříve nízký titr nebo vůbec nereaguje a teprve v průběhu času vystoupá (Tab. 1 i 2). Pro čerstvé infekce je také typický výskyt tzv. koaglutinací, kdy pozitivně reagují v nižším titru i kmeny, které nemoc nezpůsobily, což je vidět u obou výše popsaných případů. Podání antibiotik někdy způsobí potlačení imunitní reakce, kdy hodnoty nedosahují obvyklých tisícových titrů, což je dobře vidět u pacienta č. 2.
V praxi se často setkáváme také se situací, kdy vychází MAT hraničně. V mikroskopu v těchto případech vidíme aglutinované leptospiry bez zjevné lyze. V těchto případech odesíláme výsledek jako hraniční titr a doporučujeme opakovat vyšetření při přetrvávajícím podezření na leptospirózu. Může se totiž jednat o počátek infekce (jako v případě pacienta č. 2 v naší kazuistice) nebo o nespecifickou zkříženou reakci s jiným antigenem.
Kromě MAT a PCR metody jsou pro diagnostiku leptospir také k dispozici různé ELISA testy. Tato metoda je ve srovnání s MAT relativně jednoduchá. Jelikož ale dokáže detekovat pouze rodově specifické protilátky bez určení jednotlivých kmenů, její využití je vhodnější spíše v epidemiologických studiích a pro přesnou diagnostiku není tato metoda doporučována (6, 7). Jak již bylo zmíněno výše, doba, po kterou je infekci možné detekovat, se u MAT i PCR liší. Je proto vhodné obě tyto metody kombinovat, aby pravděpodobnost záchytu byla co nejvyšší. Zde prezentované výsledky to potvrzují.
| Doba od prvních klinických příznaků (dny) | MAT | PCR | |
| kmen | titr | ||
| 5 | – | – | pozitivní |
| 11 | L. icterohaemorrhagiae L. sorex L. bratislava | 100 800 400 | – |
| 23 | L. icterohaemorrhagiae L. sorex L. bratislava L. grippothyposa | 3200 800 400 100 | – |
Tab. 1: Hodnoty MAT a PCR u pacienta č. 1. Tučným písmem označen původce onemocnění.
| Doba od prvních klinických příznaků (dny) | MAT | PCR | |
| kmen | titr | ||
| 4 | L. bataviae | hraniční | pozitivní |
| 16 | L. grippothyposa L. bataviae L. sorex L. pomona | 800 hraniční hraniční hraniční | – |
| 35 | L. grippothyposa L. bataviae L. sorex | 400 hraniční hraniční | – |
Tab. 2: Hodnoty MAT a PCR u pacienta č. 2. Tučným písmem označen původce onemocnění.